深圳子科生物報道:12月23日,清華大學生命科學學院王新泉教授與醫(yī)學院向燁研究員合作在《細胞研究》(Cell Research)期刊在線發(fā)表題為《SARS冠狀病毒刺突糖蛋白冷凍電鏡結(jié)構(gòu)揭示其受體結(jié)合的必需構(gòu)象狀態(tài)》(Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding)的研究論文,解析了高致病性冠狀病毒SARS-CoV表面刺突蛋白(spike)蛋白的近原子分辨率結(jié)構(gòu),并捕捉到刺突蛋白的多種中間構(gòu)象,揭示了SARS冠狀病毒入侵宿主細胞過程中必需的動態(tài)結(jié)構(gòu)變化。
高致病性冠狀病毒感染是公共衛(wèi)生的重大威脅。2002-2003年嚴重急性呼吸道綜合征冠狀病毒(SARS-CoV)的爆發(fā)導(dǎo)致8000多人感染,800多人死亡;2012年中東呼吸系統(tǒng)綜合征冠狀病毒(MERS-CoV)從中東地區(qū)開始流行,已導(dǎo)致1800多人感染,600多人死亡。2015年世界衛(wèi)生組織列出了8種可能引起嚴重爆發(fā)性流行的危險病原體,SARS冠狀病毒和中東呼吸系統(tǒng)綜合征冠狀病毒名列其中。迄今為止,還沒有針對這兩種冠狀病毒的特異性藥物和疫苗。
冠狀病毒刺突蛋白(spike)為同源三聚體,位于病毒囊膜表面,是已知zui大的病毒表面蛋白。刺突蛋白在病毒與宿主細胞接觸,與宿主細胞受體結(jié)合以及病毒-宿主細胞膜融合過程中起著關(guān)鍵作用,同時也是中和抗體結(jié)合及疫苗研發(fā)的重要靶點。
冠狀病毒刺突蛋白從非激活態(tài)到激活態(tài)的構(gòu)象變化
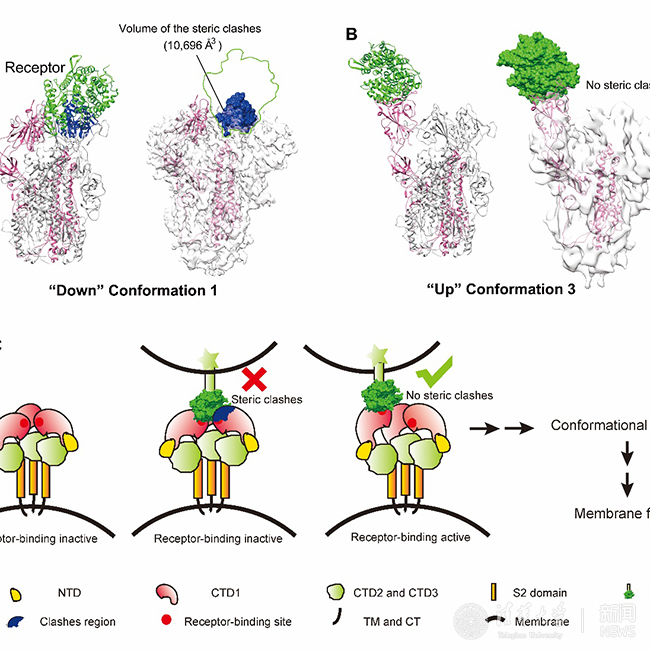
本研究通過冷凍電鏡單顆粒三維重構(gòu)的方法解析了SARS冠狀病毒刺突蛋白四種構(gòu)象的結(jié)構(gòu)。其中構(gòu)象一為三重對稱的結(jié)構(gòu),分辨率達4.3 埃,在此構(gòu)象下刺突蛋白的三個受體結(jié)合區(qū)(RBD)都處于“向下”位置,由于空間位阻,SARS冠狀病毒細胞受體血管緊張素轉(zhuǎn)化酶2(ACE2)無法結(jié)合刺突蛋白,因此該構(gòu)象為受體結(jié)合的非激活狀態(tài)。其余三種構(gòu)象刺突蛋白的對稱性被破壞,一個受體結(jié)合區(qū)抬起處于“向上”位置,在該構(gòu)象下細胞受體能順利結(jié)合抬起的受體結(jié)合區(qū)而沒有空間位阻,因此這三種構(gòu)象為受體結(jié)合的激活狀態(tài)。受體結(jié)合區(qū)從“向下”位置到“向上”位置的轉(zhuǎn)換也是中和性抗體與spike的結(jié)合所必需,并且可推廣到中東呼吸系統(tǒng)綜合征冠狀病毒等其他類似的冠狀病毒,這對理解冠狀病毒侵染宿主細胞的分子機制,以及特異性藥物和疫苗的開發(fā)提供了重要指導(dǎo)。
王新泉教授和向燁研究員均為北京結(jié)構(gòu)生物學高精尖創(chuàng)新中心及清華大學醫(yī)學院傳染病研究中心成員,長期從事病毒侵染及免疫逃逸相關(guān)的結(jié)構(gòu)生物學研究。2013、2014和2015年,王新泉教授和張林琦教授團隊在《細胞研究》(Cell Research)、《科學-轉(zhuǎn)化醫(yī)學》(Science Translational Medicine)和《科學報告》(Scientific Reports)上分別報道了中東呼吸系統(tǒng)綜合征冠狀病毒表面刺突蛋白的受體結(jié)合區(qū)受體結(jié)合區(qū)與人受體二肽基肽酶4(DPP4)復(fù)合物的晶體結(jié)構(gòu),靶向受體結(jié)合區(qū)的中東呼吸系統(tǒng)綜合征冠狀病毒人源中和性抗體MERS-4和MERS-27的篩選與鑒定,以及MERS-27發(fā)揮中和作用的分子機制。2016年2月,向燁研究員團隊與合作者在《科學》(Science)期刊上報道了埃博拉病毒表面糖蛋白GP與中和抗體的冷凍電鏡結(jié)構(gòu)和中和機制;6月,向燁研究員團隊又獨立在《自然》(Nature)期刊上報道了噬菌體突破細菌細胞膜的新機制。此次,兩研究組共同協(xié)作,解析了SARS冠狀病毒刺突蛋白的冷凍電鏡結(jié)構(gòu),并捕捉到了病毒侵染過程中關(guān)鍵的中間狀態(tài),極大地促進了研究界對病毒侵染機制的理解。
清華大學醫(yī)學院向燁研究組聯(lián)合培養(yǎng)博士生桂淼和生命學院2014級博士生宋文飛為本論文的共同*作者,王新泉教授和向燁研究員為本論文的共同通訊作者。
王新泉教授實驗室博士生周海霞,向燁研究員實驗室博士生許靖蔚和陳思煉參與了本項工作。該工作的冷凍電鏡數(shù)據(jù)采集在國家蛋白質(zhì)科學設(shè)施(北京)的清華大學冷凍電鏡平臺完成,數(shù)據(jù)處理在國家蛋白質(zhì)科學設(shè)施(北京)清華大學高性能計算平臺完成。本工作獲得國家自然科學基金委、科技部重點研發(fā)計劃和北京市結(jié)構(gòu)生物學高精尖創(chuàng)新中心等的經(jīng)費支持。




